Svaka kutija lijeka na tržištu Europske unije mora imati sigurnosne oznake, zaštitu od otvaranja i sustav verifikacije od 9. veljače 2019. godine, dakle za najkasnije tri godine. Dok je domaća generička industrija zabrinuta, jer će im primjena iz džepa izbiti možda i stotine milijuna kuna, predstavnici inovativnih lijekova jedva su dočekali novu regulativu koja u fokus stavlja zaštitu i povećanje sigurnosti za sve pacijente u čitavoj Europi.
Naime, nova pravila u farmaceutskoj industriji donosi europska Direktiva o krivotvorenim lijekovima (FMD-Falsified Medicines Directive) koju je EU Parlament usvojio 2011. godine, a 9. veljače ove godine konačno je usvojena i objavljena Delegirana Uredba vezana uz implementaciju sigurnosne značajke u zemljama članicama. Pred Vladom i strukom je da osmisle implementaciju Direktive koja će zadovoljiti stroge standarde, a da se istodobno olakša domaćoj industriji lijekova koju je bivša Vlada prozvala strateškom, zbog visoke razine ulaganja i doprinosu BDP-u.
3godine
zemlje članice imaju vremena za implementaciju Direktive
Kako kažu naši izvori iz struke, osnovno pitanje bit će kako minimalizirati troškove i zadržati stabilnost tržišta i opskrbu lijekova, pogotovo onih najjeftinijih čija bi cijena mogla biti čak znatno niža od troškova zaštite. Cilj Direktive FMD je zaštita potrošača od krivotvorenih lijekova koji su sve češća prijetnja s napretkom interneta i mobilnih tehnologija, a tehnološko rješenje koje će se primijeniti trebalo bi ne samo zaustaviti prodaju sumnjivih lijekova putem interneta, već i omogućiti praćenje prometa lijekova od proizvođača do pacijenta, bilo u bolnicama ili kroz ljekarne.
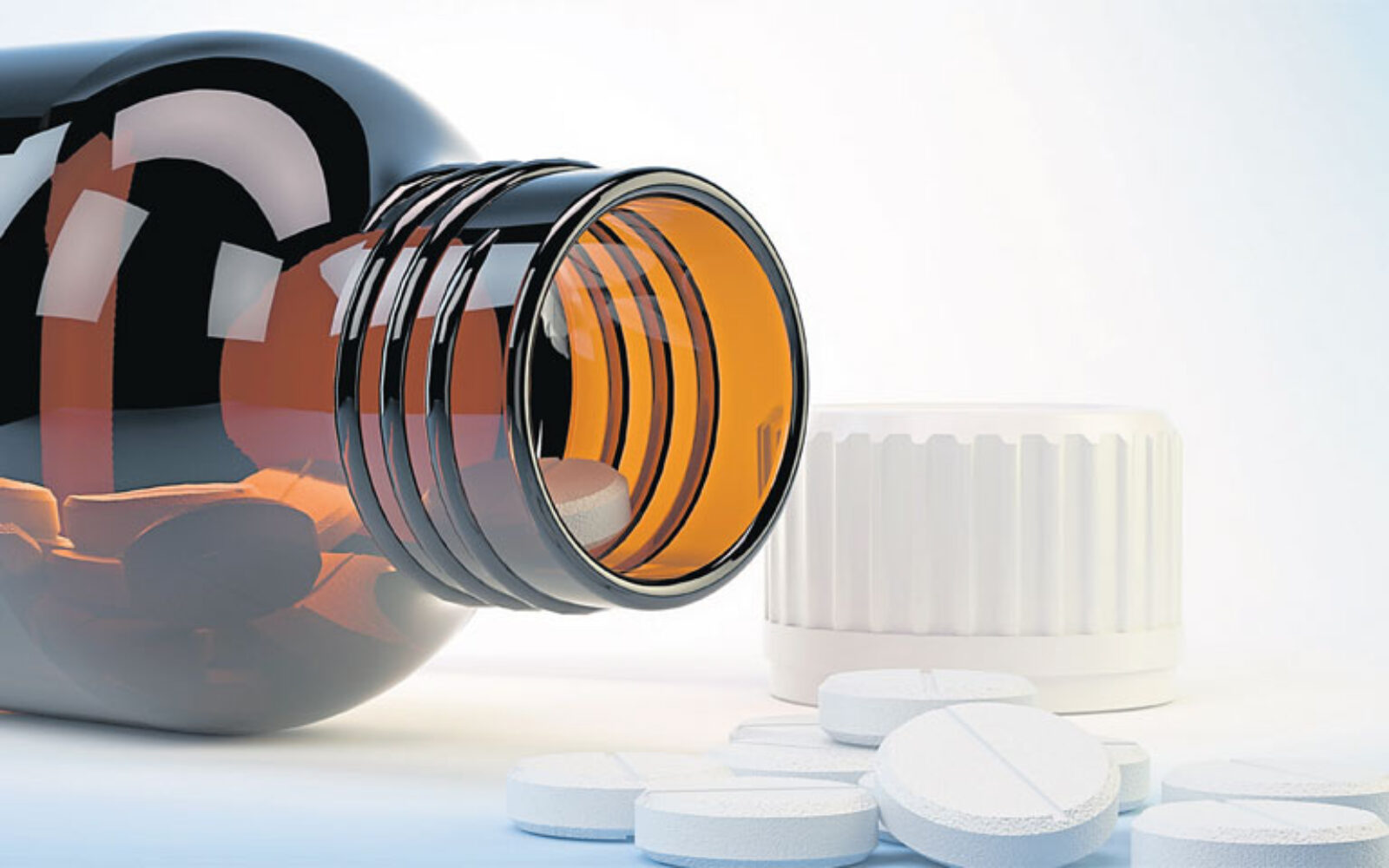
Uredba utvrđuje obilježja i tehničke specifikacije jedinstvenog identifikatora koji omogućava provjeru autentičnosti lijeka i identifikaciju svakog pojedinog pakiranja, modalitete provjere sigurnosnih oznaka. "Cilj je spriječiti da krivotvoreni lijekovi uđu u legalni opskrbni lanac i dospiju do pacijenta. Od početka 2019. godine svaki će pacijent moći biti siguran da je u ljekarni ili bolnici dobio lijek potvrđene autentičnosti i neotvaran", ističu u Udruzi iF! (Inovativna farmaceutska inicijativa), koja predstavlja 25 inovativnih farmaceutskih kompanija (Bayer, GSK, Pfizer, AstraZeneca…). Objašnjavaju kako je provjera jedinstvenog, nasumce kreiranog serijskog broja na svakom pakiranju u središnjoj bazi podataka u trenutku izdavanja trenutačno jedan od najsigurnijih načina da se provjeri autentičnost lijeka.
Ujedno, sustav provjere lijekova može jamčiti sadržaj pakiranja samo ako je pakiranje cijelo vrijeme zatvoreno. Stoga se propisuje i uporaba pakiranja koje sadrži zaštitu od otvaranja i jasno pokazuje je li pakiranje bilo otvarano ili neovlašteno mijenjano i stoga je ono nužna nadopuna sustava za provjeru lijekova. U Udruzi iF najavljuju "suradnju s drugim dionicima na uspostavi novog sustava". Domaći proizvođači okupljeni oko Udruge proizvođača lijekova Hrvatske udruge poslodavaca (HUP) također su formirali stručni tim koji aktivno radi na analizi Direktive i modalitetima njezine primjene. Upozoravaju na visoke troškove implementacije, zbog čega će od države tražiti pomoć.
"Još ne možemo precizno reći koliki će biti trošak implementacije, ali sigurno je da govorimo o desecima pa i stotinama milijuna kuna. Riječ je, naime, o iznimno složenom i zahtjevnom procesu za domaće proizvođače lijekova, ne samo financijski, nego i tehnički, jer će i sam proces proizvodnje lijekova biti potrebno u određenoj mjeri mijenjati i prilagoditi zahtjevima", izjavila je Milka Kosanović, direktorica Udruge. Domaći proizvođači stoga očekuju pomoć ili rasterećenje poslovanja od nekih drugih nameta. "Jasno je da je to golem teret, koji će u konačnici u najvećoj mjeri morati iznijeti farmaceutske kompanije. Domaći proizvođači lijekova, već doista nepotrebno preopterećeni nametima, taj teret će sasvim sigurno vrlo teško moći ukalkulirati u svoje poslovanje. Određena pomoć ili, bolje rečeno, olakšice, osobito u rasterećenju poslovanja od drugih nameta, u tome smislu će svakako biti nužne", kažu u HUP-u.










Važna obavijest:
Sukladno članku 94. Zakona o elektroničkim medijima, komentiranje članaka na web portalu Poslovni.hr dopušteno je samo registriranim korisnicima. Svaki korisnik koji želi komentirati članke obvezan je prethodno se upoznati s Pravilima komentiranja na web portalu Poslovni.hr te sa zabranama propisanim stavkom 2. članka 94. Zakona.Uključite se u raspravu